Natri bicacbonat
碳酸氢钠
维基百科,自由的百科全书
此条目没有列出任何参考或来源。(2011年5月24日)
維基百科所有的內容都應該可供查證。
请协助添加来自可靠来源的引用以改善这篇条目。无法查证的内容可能被提出异议而移除。
碳酸氢钠
IUPAC名
Sodium hydrogen carbonate
别名
小苏打、蘇打粉、梳打粉(香港)、重碳酸钠、酸式碳酸钠、焙烧苏打、重曹、重碱
识别
RTECS
VZ0950000
性质
化学式
NaHCO3
摩尔质量
84.007 g·mol−1
外观
白色晶体
密度
2.159 g/cm3 (固)
熔点
270 °C 分解
折光度n
D
1.500
危险性
主要危害
对呼吸系统具刺激性
0
1
0
闪点
不可燃
相关物质
若非注明,所有数据来自25 ℃,100 kPa。
碳酸氢钠(化学式:NaHCO3),俗称小苏打、蘇打粉、梳打粉(香港)、重曹、焙用鹼等,白色细小晶体,在水中的溶解度小于苏打。
50℃以上開始逐漸分解生成碳酸钠、二氧化碳和水,270℃時完全分解。碳酸氢钠是强碱與弱酸經中和作用後生成的酸式鹽,溶於水時呈現弱鹼性。
- 2NaHCO3 → Na2CO3 + H2O + CO2
常利用此特性作為食品制作过程中的膨松剂。
碳酸氫鈉,是一种易溶于水的白色碱性粉末,在与水结合后开始起作用释出二氧化碳CO2,在酸性液体(如:果汁)中反应更快,而随着环境温度升高,释出气体的作用愈快。
碳酸氫鈉在作用后会残留碳酸钠,使用过多会使成品有碱味。
碳酸氫鈉水溶液呈弱鹼性,俗稱小蘇打及焙用鹼。
[编辑] 制法
- Na2CO3+ CO2+ H2O→2NaHCO3
在此反应中,碳酸氢钠由于溶解度低而析出。
[编辑] 應用
- 碳酸氫鈉也经常被用来做为中和剂,例如巧克力蛋糕。巧克力为酸性,大量使用时会使西点带有酸味,因此可使用少量的碳酸氫鈉做为膨大剂并且也中和其酸性。同时,碳酸氫鈉也有使巧克力加深颜色的作用,使它看起来更黑亮。
Bách khoa toàn thư mở Wikipedia
Bicacbonat natri
Danh pháp IUPAC
Sodium hydrogen carbonate
Tên khác
Natri bicacbonat
Bột nở
Bột nổi
Nahcolit
Natri hiđrocacbonat
Nhận dạng
Số RTECS
VZ0950000
Thuộc tính
Công thức phân tử
NaHCO3
Phân tử gam
84,007 g/mol
Bề ngoài
Chất rắn kết tinh màu trắng.
Tỷ trọng
2,159 g/cm3, rắn.
Phân hủy tại 50 °C
Độ hòa tan trong nước
7,8 g/100 ml (18 °C)
Chiết suất (nD)
1,500
Các nguy hiểm
Chỉ mục EU
Không liệt kê
Điểm bắt lửa
Không cháy
Các hợp chất liên quan
Anion khác
Cacbonat natri
Cation khác
Bicacbonat kali
Bicacbonat amoni
Hợp chất liên quan
Bisulfat natri
Photphat dinatri
Ngoại trừ khi có ghi chú khác, các dữ liệu được lấy
cho hóa chất ở trạng thái tiêu chuẩn
(25 °C, 100 kPa)
Phủ nhận và tham chiếu chung
Natri hiđrocacbonat hay natri bicacbonat là tên gọi phổ biến trong hóa học, còn tên thường gọi bình dân là bột nở, bột nổi, thuốc sủi v.v. Nó có công thức hóa học NaHCO3.
Thường ở dạng bột mịn, trắng, dễ hút ẩm, tan nhanh trong nước, khi có sự hiện diện của ion H+ khí CO2 sẽ phát sinh và thoát ra. Sử dụng nhiều trong các ngành công nghiệp hóa chất, thực phẩm, dược phẩm.
Bicarbonate de sodium
Un article de Wikipédia, l'encyclopédie libre.
Aller à : Navigation, rechercher
Bicarbonate de sodium
Structure du bicarbonate de sodium
Général
Nom IUPAC
hydrogénocarbonate de sodiumSynonymes
Bicarbonate de soude (appellation fausse)No E
E500(ii)C(O)(=O)[O-].[Na+]
PubChem, Vue 3D[Afficher][Masquer]
InChI
InChI : Vue 3D
InChI=1/CH2O3.Na/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1[Afficher][Masquer]
Apparence
solide blanc de formes variables[1].Propriétés chimiques
Formule brute
CHNaO3NaHCO3Masse molaire[2]
84,0066 ± 0,0018 g·mol−1
C 14,3 %, H 1,2 %, Na 27,37 %, O 57,14 %,pKa
10,3Propriétés physiques
T° fusion
50 °C (décomposition)[3]Solubilité
87 g·l-1 (eau, 20 °C)[1]
Insol. dans l'EtOH[3]Masse volumique
2,22 g·cm-3 (20 °C)[4]Thermochimie
Cp
87,7 kJ·K-1·mol-1 (25 °C)[3]Précautions
SIMDUT[5]
Produit non contrôlé
Ce produit n'est pas contrôlé selon les critères de classification du SIMDUT.
[+][–]
Unités du SI & CNTP, sauf indication contraire.
L'hydrogénocarbonate de sodium ou bicarbonate de sodium ou carbonate monosodique ou bicarbonate de soude (appellation la plus commune, mais ne correspondant pas aux dénominations normalisées des composés chimiques) ou carbonate acide de sodium (appellation la plus employée dans la composition des pâtisseries industrielles) a pour formule NaHCO3. C'est un composé blanc, qui se présente sous forme de poudre.
Sommaire
[masquer]Histoire[modifier]
Les Égyptiens de l'Antiquité utilisaient déjà les propriétés du natron, un minéral composé de carbonate de sodium et de bicarbonate de sodium. Ils tiraient cette substance de l'évaporation des lacs salés et l'employaient pour se frotter le corps, comme un savon.
En 1791, un chimiste français élabore pour la première fois le bicarbonate de sodium, tel que nous le connaissons aujourd'hui, cependant le raffinage du carbonate de sodium pour donner du bicarbonate de sodium a été mis au point en 1846 par deux boulangers new-yorkais : John Dwight et Austin Church.
Production et synthèse[modifier]
Le bicarbonate de sodium peut être obtenu à partir de gisements de natron.
Le procédé dit "Solvay", du nom de son inventeur, produit du carbonate de sodium (Na2CO3) à partir de sel et de craie. Puis ce carbonate de sodium donne du bicarbonate de sodium selon la réaction suivante :
- Na2CO3 + H2O + CO2 → 2 NaHCO3
Propriétés physico-chimiques[modifier]
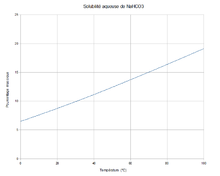
Solubilité aqueuse
Le bicarbonate de sodium est biodégradable et n'est toxique ni pour l'environnement ni pour la santé.
Le bicarbonate de sodium ne doit pas être confondu avec la soude caustique ni avec le carbonate de sodium.
Le bicarbonate de sodium perd du dioxyde de carbone à 50 °C et est converti en carbonate de sodium à 100 °C[3].
Les utilisations[modifier]
Le bicarbonate rend de nombreux services pour l'entretien du linge et de la maison, mais aussi pour l'hygiène, les soins du corps et pour la cuisine.
Pour la maison[modifier]
- agent nettoyant ;
- adoucisseur d'eau ;
- désodorisant ;
- rafraîchit les tapis ;
- utilisé dans certains extincteurs à poudre ;
- Il peut être utilisé pour éteindre un incendie lorsque l'usage de l'eau est déconseillé. Par exemple pour les feux de friture.
- Il bloque le développement des allergènes d'acariens acari (Dermatophagoïdes pteronyssinus et D. farinae) - 20 g/m2 en poudre sur les tapis, moquette et matelas
- Utilisé contre les fourmis en bouchant les trous avec un peu de bicarbonate.
Pour les soins du corps (bicarbonate alimentaire)[modifier]

Cet article ne cite pas suffisamment ses sources (juillet 2010).
Si vous disposez d'ouvrages ou d'articles de référence ou si vous connaissez des sites web de qualité traitant du thème abordé ici, merci de compléter l'article en donnant les références utiles à sa vérifiabilité et en les liant à la section « Notes et références ». (Modifier l'article)
- blanchit les dents (dentifrice confectionné en mélangeant avec de l'eau oxygénée) - attention, le bicarbonate agit par abrasion et l'eau oxygénée attaque les gencives : n'en abusez pas ;
- nettoie la peau en profondeur (gommage) : confectionner une pâte avec trois volumes de bicarbonate et un volume d'eau, masser doucement la peau par cercles concentriques et rincer. La peau est prête à recevoir une crème hydratante.
- attendrit les durillons et réduit la démangeaison occasionnée par le pied d'athlète - attention, le pied d'athlète est une mycose, qu'il faut traiter : combattre les symptômes ne suffit pas, il faut consulter un médecin ;
- utilisé pour les gargarismes - attention, le mal de gorge peut être dû à une maladie : s'il persiste plus de quelques jours, consultez un médecin ;
- calme les maux d'estomac, en buvant une préparation réalisée avec une cuillerée à café de bicarbonate de sodium dans un verre d'eau froide - attention, le mal d'estomac peut être dû à une maladie : s'il persiste plus d'un jour ou deux, consultez un médecin ;
- calme l'eczéma (une demi-tasse de bicarbonate de sodium dans un bain chaud de 15 à 20 minutes) - attention, l'eczéma peut être dû à des causes graves, comme allergies, stress etc. : s'il persiste, consultez un médecin ;
- calme les coups de soleil avec des compresses trempées dans une solution réalisée avec une cuillerée à soupe de bicarbonate de sodium dans 25 cl d'eau - les coups de soleil causent des cancers de la peau et sont à éviter absolument, par ailleurs, le bicarbonate de sodium ne dispense pas d'utiliser également une crème réparatrice une fois le mal fait et un écran protecteur pour éviter de l'aggraver ;
- utilisé aussi pour les boutons de fièvre, les gencives douloureuses, les maux de gorge, les mycoses, les piqûres d'insectes et les verrues - attention, le bouton de fièvre est un symptôme de l'herpès, qui est très contagieux : le bicarbonate de sodium n'empêche pas la contagion, consultez un médecin - attention, mycoses et verrues sont des maladies qu'il faut traiter correctement, consultez un médecin.
- Nettoie les dreadlocks en profondeur, pour en éliminer toutes les poussières et autres pollutions de la vie quotidienne.
Pour la cuisine (bicarbonate alimentaire)[modifier]
- mélangé à de l'acide citrique et des cristaux de gélatine vous obtenez du sucre pétillant (après avoir chauffé)
- mélangé avec de l'acide dans la levure chimique, il dégage du dioxyde de carbone, ce qui rend les plats plus aérés et plus digestes ;
- facilite la digestion des aliments ;
- jeté dans l'eau bouillante (une pincée par litre d'eau), il garde leur couleur verte aux légumes cuits à l'eau tels que les haricots verts ou les brocolis.
- dans les aliments industriels, c'est l'additif alimentaire numéro E500(ii)[6]. Il est utilisé comme agent de levuration, anti-agglomérant ou comme régulateur de pH[7].
Autres utilisations[modifier]
- anodisation de l'aluminium ;
- purification des fumées et reminéralisation des eaux ;
- jardinage : fongicide (pour lutter contre l'oïdium par exemple) et utilisé contre les fourmis en solution et en grande quantité (plus de 3 litres soit deux bouteilles classiques) à verser dans la fourmilière.
- Formation de crack à partir de cocaïne
Annexes[modifier]
Au Québec, dans le langage courant, il peut être appelé parfois la « petite vache ». Cela en raison de la petite vache représentée sur les boîtes de bicarbonate de sodium vendues par la compagnie Cow Brand, il y a de cela plusieurs années.









没有评论:
发表评论